Zentiva România, cel mai mare producător român de generice în volum, va începe din 9 februarie distribuția și comercializarea medicamentelor îndeplinind noile criterii de siguranță.
Potrivit Directivei 2011/62/UE, de la această dată, medicamentele cu prescripție medicală pot fi puse în circulație în spațiul comunitar doar dacă dețin două elemente de siguranță la nivelul ambalajelor: un cod care permite verificarea în timp real a autenticității produsului și producătorului și un sistem de integritate care indică dacă ambalajul a fost deschis sau modificat după momentul ieșirii din producție.
Directiva europeană reprezintă răspunsul UE la creșterea îngrijorătoare a cantităților de medicamente falsificate care au ajuns la pacienți în mod ilicit sau legal. Sistemul European de Verificare a Medicamentelor (SEVM), la care România este parte prin Sistemul Național de Verificare a Medicamentelor, permite farmaciilor, importatorilor, distribuitorilor și altor părți interesate să poată verifica în baza de date securizată dacă fiecare cutie de medicamente intrată sau disponibilă pe piață este originală. Se consideră falsificat produsul farmaceutic pentru care se prezintă în mod fals identitatea (ambalaj, etichetare, denumire, compoziție sau concentrația ingredientelor), sursa (producătorul, țara de fabricație, deținătorul autorizației de punere pe piață) sau istoricul (înregistrările sau documentele referitoare la canalele de distribuție).
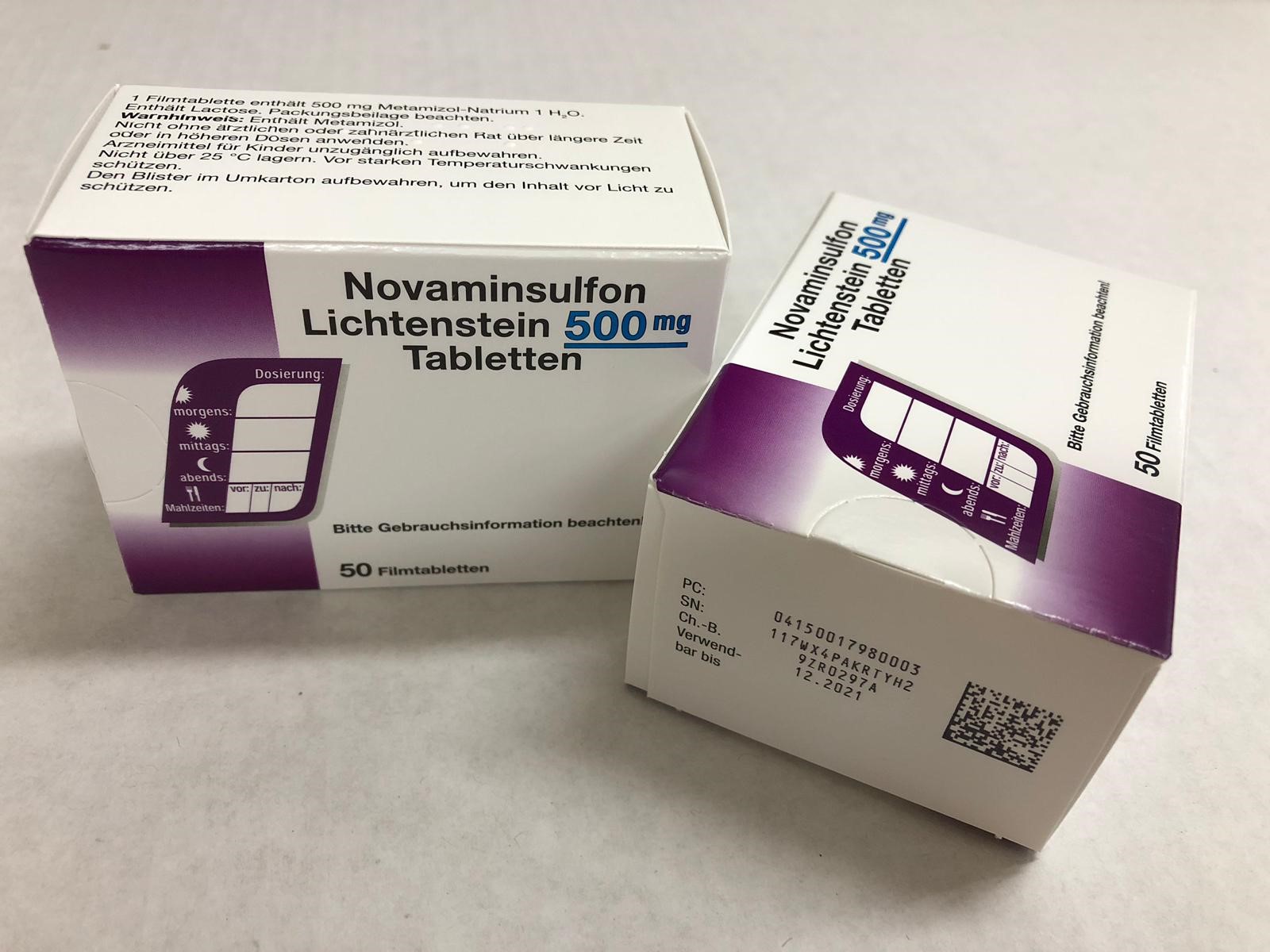
Directiva vizează medicamentele umane eliberate cu prescripție medicală și nu se aplică celor care se eliberează fără prescripție medicală. Excepțiile pentru ambele categorii sunt definite în documentațiile conexe directivei. Aplicarea directivei este obligatorie începând cu 9 februarie. Produsele farmaceutice deja existente în stocurile farmaciilor și ale distribuitorilor la această dată, fără noile elemente de securitate dar certificate și eliberate pentru distribuție, pot fi puse pe piață până la data expirării.
„Zentiva România a parcurs toate demersurile necesare pentru implementarea noului sistem de serializare, de la utilarea liniilor de ambalare, care corespund noilor cerințe, la actualizarea documentației produsului, notificarea autorităților, implementarea în producție și înscrierea tuturor DAPP (deținător de autorizație de punere pe piață) în OSMR (Organizația de Serializare a Medicamentelor din România), cât și la EMVO (Organizația Europeană pentru Verificarea Medicamentelor)” a declarat Simona Cocoș, Director General Zentiva România.
Astfel, toate seriile de medicamente Zentiva, eliberate după data de 9 februarie 2019 vor respecta criteriile de siguranță, prezentând cele 2 sisteme de siguranță standard:
Sistem de siguranță 1: cod 2D care conține un număr serial unic pe lângă informațiile uzuale (lot, cod produs, data de expirare).
Sistem de siguranță 2: element de securizare a cutiei (sigilare sau lipire sau etichetă specială), care indică pacientului dacă ambalajul a fost deschis anterior.
Pentru mai multe informații, vă rugăm să contactați:
Ioana Lucescu, Director de Comunicare Zentiva
Ioana.lucescu@zentiva.com, 0747.051.338